FDA vừa phê duyệt vắc xin COVID-19 mới của Pfizer và Moderna ngừa được biến chủng EG.5. Theo dự kiến, loại vắc xin mới này sẽ ra mắt công chúng vào giữa tháng 9/2023.
>>Vắc xin gắn kết nhân viên trong giai đoạn "bình thường mới"
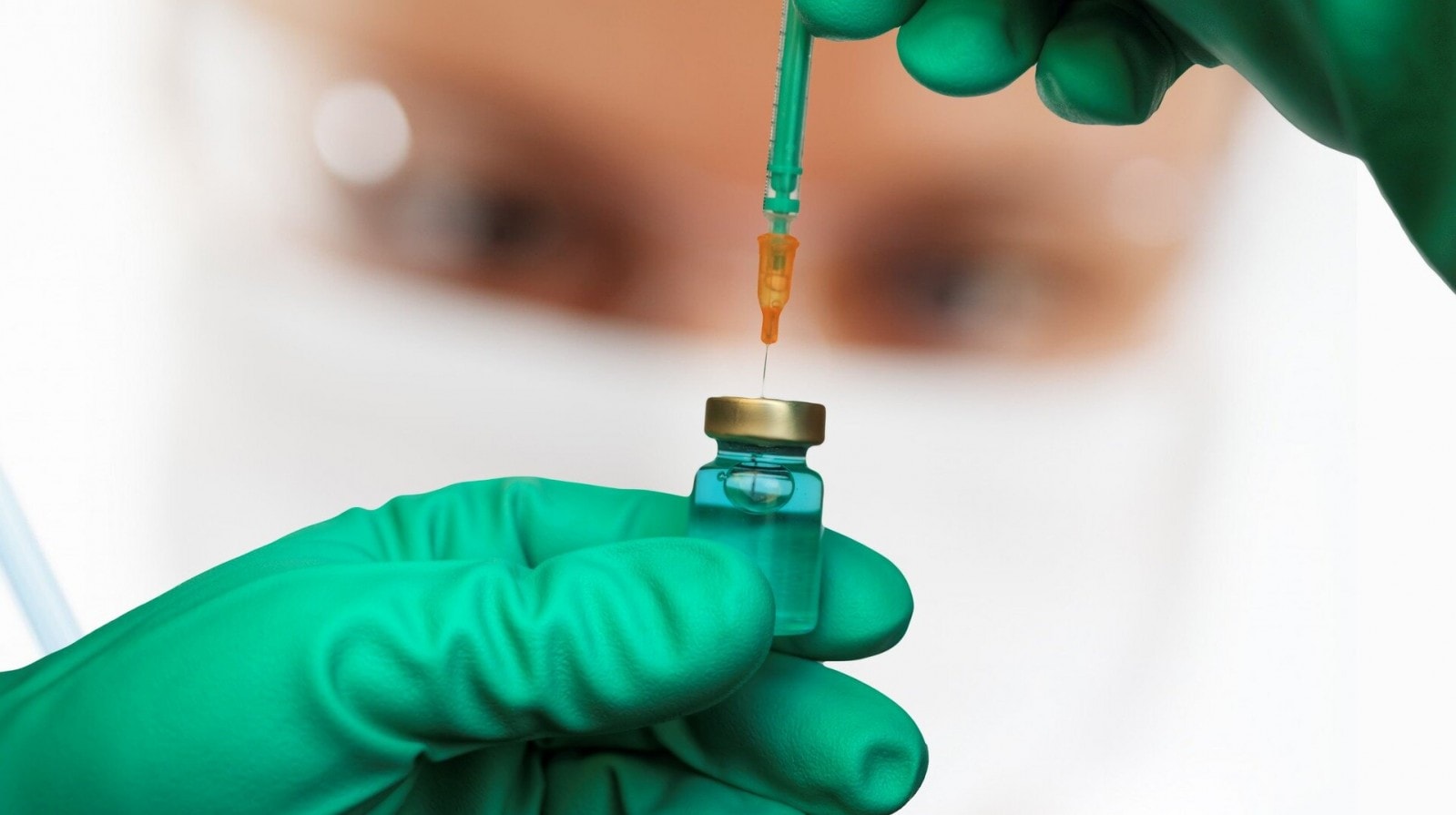
FDA vừa phê duyệt bản vắc xin Covid-19 mới được cập nhật từ Pfizer và Moderna
Cục Quản lý Thực phẩm và Dược phẩm Mỹ (FDA) vừa phê duyệt bản vắc xin Covid-19 mới được cập nhật từ Pfizer và Moderna trong bối cảnh số ca nhập viện vì dịch bệnh này của Mỹ liên tục gia tăng.
Theo thông báo từ FDA, loại vắc xin mới này nhắm vào biến thể Omicron XBB.1.5. Chúng được dùng cho người từ 12 tuổi trở lên và có thể sử dụng cho trẻ em từ 6 tháng đến 11 tuổi trong trường hợp khẩn cấp.
Tuy nhiên, người dân Mỹ vẫn chưa thể sử dụng loại vắc xin mới này ngay lập tức. Bởi vì vào ngày 12/9/2023, một ban cố vấn của CDC (Trung tâm Kiểm soát và Ngăn ngừa Dịch bệnh) sẽ bỏ phiếu để quyết định xem có nên đưa ra khuyến nghị sử dụng các liều vắc xin này hay không. Chỉ sau khi được giám đốc CDC phê duyệt, thì các hiệu thuốc, cơ sở y tế và những nơi phân phối vắc xin mới được quyền hành động.
Hồi tháng 8/2023, chính quyền Biden cho biết họ kỳ vọng các loại vắc xin đơn chủng mới từ Pfizer, Moderna và Novavax có tác dụng lên chủng XBB.1.5 sẽ được dùng rộng rãi từ giữa tháng 9/2023. Mặc dù vậy trong thông báo ngày 11/9 vừa qua, FDA không đề cập đến vắc xin của Novavax. Tuy nhiên Novavax lại khẳng định FDA vẫn đang xem xét vắc xin của họ. Sau thông báo từ FDA, cổ phiếu Novavax khi đóng cửa giảm gần 13%.
Vắc xin của Novavax là loại protein-based, một công nghệ có tuổi đời hàng chục năm, từng được sử dụng trong các chương trình tiêm chủng định kỳ ngừa viêm gan B và zona. Trong khi đó vắc xin của Pfizer và Moderna là vắc xin mRNA, một công nghệ mới hơn, có công dụng “dạy” tế bào tạo ra protein kích hoạt phản ứng miễn dịch chống lại Covid-19.
Sự xuất hiện của các phiên bản vắc xin mới giúp người Mỹ yên tâm hơn phần nào trong bối cảnh quốc gia này ghi nhận số ca nhiễm và nhập viện vì Covid-19 tăng đáng kể. Mặc dù các loại vắc xin mới không nhắm vào các biến chủng đang thịnh hành hiện nay, nhưng Pfizer và Moderna khẳng định chúng vẫn giúp cơ thể tăng cường khả năng chống lại các biến chủng này. Điều này khá quan trọng vì mùa tựu trường đang đến và thời tiết đang dần trở nên lạnh hơn.
Theo dữ liệu mới nhất từ CDC, số ca nhập viện vì COVID-19 tăng trong bảy tuần liên tiếp, cũng như tăng hơn 15%, tức 17.418 ca, trong tuần kết thúc vào ngày 26/8. Tuy nhiên con số này vẫn thấp hơn đợt tăng đột biến vào mùa hè năm 2022.
Đợt bùng phát này là do biến chủng virus mới EG.5 (Eris), một chủng cũng liên quan đến omicron XBB.1.5. Các thống kê cho thấy những biến chủng họ omicron chiếm 21,5% tất cả các ca nhiễm tính đến ngày 2/9/2023.
Pfizer, Moderna và Novavax đã công bố những dữ liệu thử nghiệm ban đầu cho thấy vắc xin mới của họ có tác dụng chống lại Eris. Ngoài ra, Pfizer và Moderna tuyên bố vắc xin của họ cũng tạo ra phản ứng miễn dịch đối với BA.2.86, một biến thể omicron mà giới chức đang theo dõi chặt chẽ.
Trong thông báo ngày 11/9 vừa qua, FDA đồng thời cho biết họ không còn cấp phép cho các mũi tăng cường hồi năm ngoái của Pfizer và Moderna nữa. Lần triển khai vắc xin sắp tới đây sẽ là lần triển khai đầu tiên kể từ khi Mỹ tuyên bố kết thúc tình trạng khẩn cấp vì đại dịch.
Kết thúc tình trạng khẩn cấp đồng nghĩa với việc chính phủ liên bang sẽ chuyển việc phân phối vắc xin sang các đơn vị tư nhân. Khi đó, các nhà sản xuất vắc xin sẽ bán vắc xin trực tiếp đến các cơ quan y tế với giá cao hơn. Tuy nhiên chính phủ Mỹ cũng có những chương trình giúp người dân được tiêm ngừa miễn phí.
Hồi tuần trước, Nhà Trắng cho biết họ sẽ kêu gọi người Mỹ đi tiêm vắc xin bản cập nhật. Mặc dù vậy, vẫn chưa biết liệu người Mỹ có thực sự sốt sắng với đợt triển khai vắc xin mới này hay không. Theo thống kê từ CDC, chỉ khoảng 17% dân số Mỹ, tương đương 56 triệu người, tiêm mũi tăng cường từ Pfizer và Moderna, kể từ khi hai loại vắc xin này được cấp phép vào tháng 9/2022.
Có thể bạn quan tâm